Vezi și alte cazuri
Hepaticogastroanastomoză în colangiocarcinom perihilar
Pacientă în vârstă de 72 de ani, fără istoric medical semnificativ, s-a prezentat la spital pentru icter sclero-tegumentar debutat de 3 săptămâni și accentuat progresiv, fără alte acuze subiective.
Clinic – scor ECOG 2, supraponderală, afebrilă, cu tegumente și sclere intens icterice, fără dureri abdominale, însă cu scaune acolice si urini hipercrome.
Biologic – colestază importantă cu bilirubina totală 37 mg/dl, predominând bilirubina directă 34 mg/dl, GGT 1754 U/L, FAL 733 U/L, precum și citoliză hepatică cu GOT 265 U/L, GPT 390 U/L; CA 19-9 avea o valoare peste 10000 UI/ml, fără sindrom inflamator.
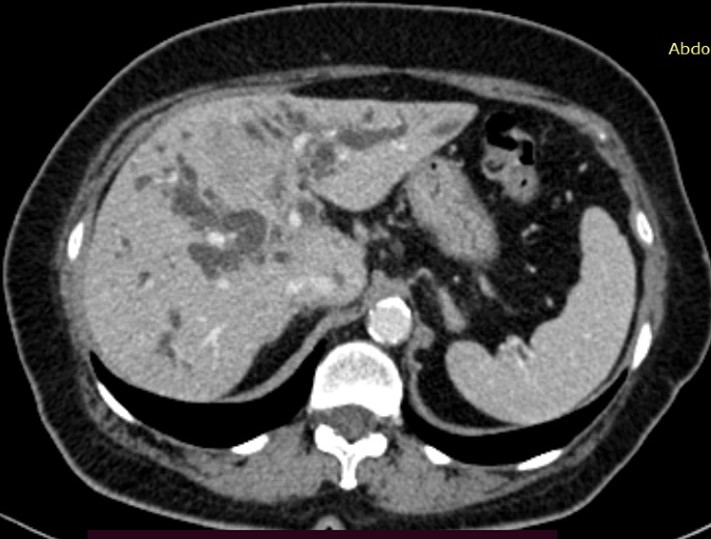
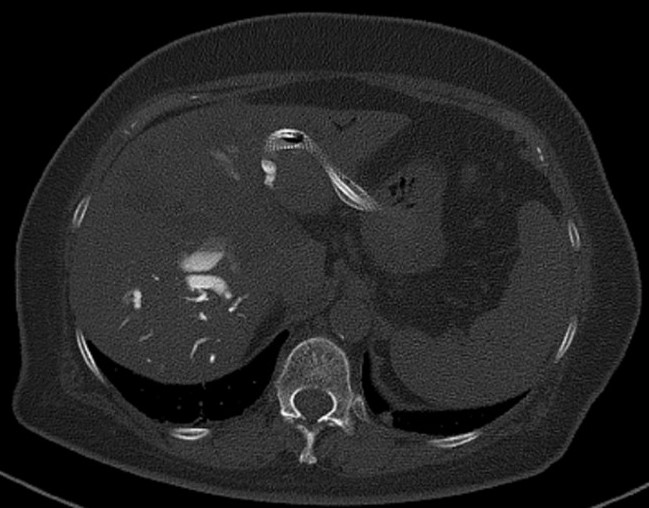
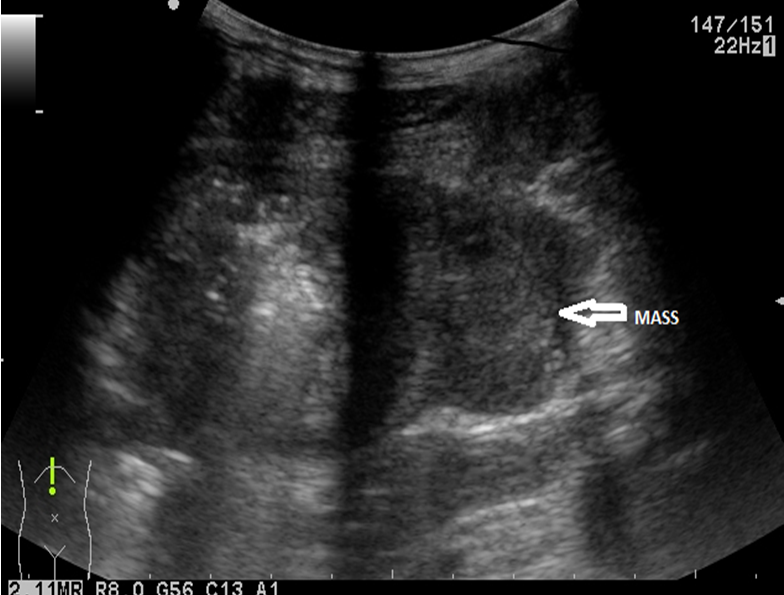
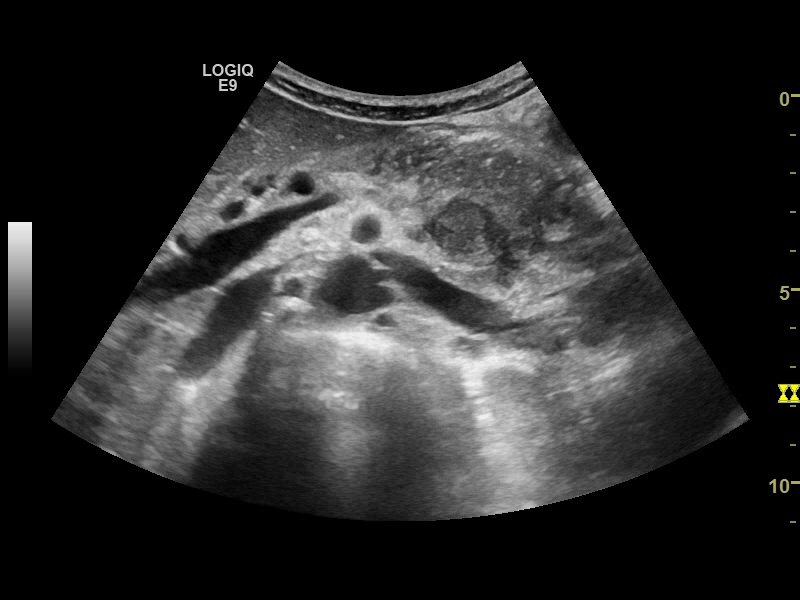
Ecografia abdominală a identificat un ficat intens neomogen, cu dilatație marcată a canalelor biliare intrahepatice, precum și o imagine neomogenă, imprecis delimitată, situată pe aria de proiecție a hilului hepatic, ce amputa calea biliară principală. CT cu substanță de contrast a confirmat prezența unui proces expansiv la nivelul hilului hepatic (Fig. 1) cu implicarea carrefourului biliar și extensie cranială la nivelul ductelor hepatice stâng și drept, cu dimensiuni de 50/25/52 mm, aspect sugestiv de tumoră Klatskin tip IV Bismuth-Corlette, precum și importante dilatații de căi biliare intrahepatice în ambii lobi; nu s-a descris invazie a venei porte. Diagnosticul a fost confirmat prin efectuarea unei ecoendoscopii (EUS) cu puncție fină aspirativă (FNA) cu ac de 22G, histologic identificându-se un colangiocarcinom perihilar slab diferențiat G3.
În urma întrunirii comisiei multidisciplinare, având în față o tumoră inoperabilă, local avansată și un icter obstructiv in progresie clinică și biologică, ce trebuia rapid și eficient ameliorat pentru inițierea chimioterapiei, precum și după obținerea acordului pacientei, s-a decis practicarea unei hepatico-gastroanastomoze ghidate ecoendoscopic (EUS-HGS), urmată de o colangio-pancreatografie endoscopică retrogradă (ERCP) în vederea decompresiei lobului drept hepatic.
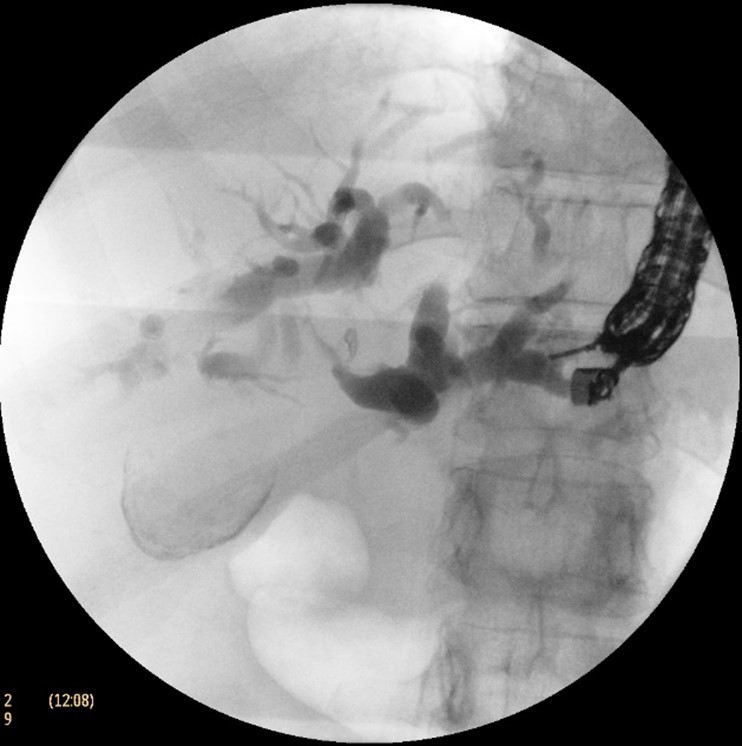
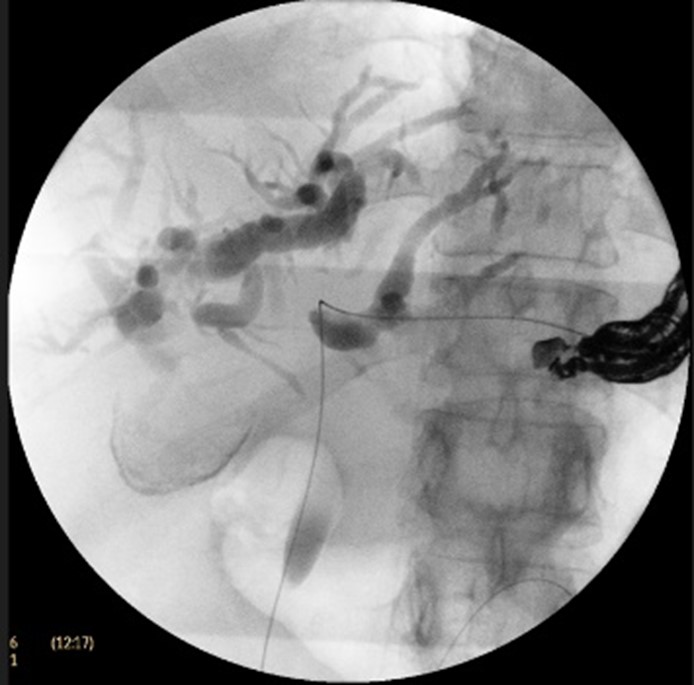
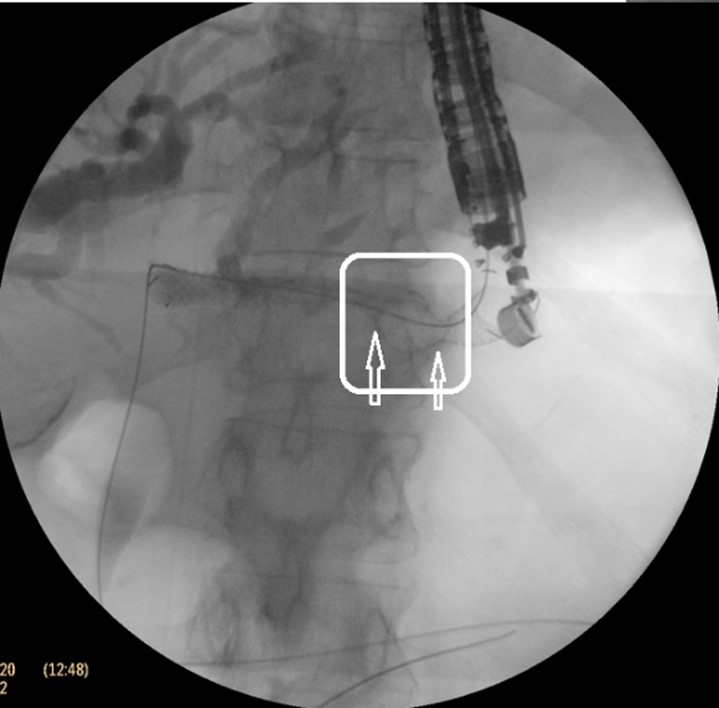
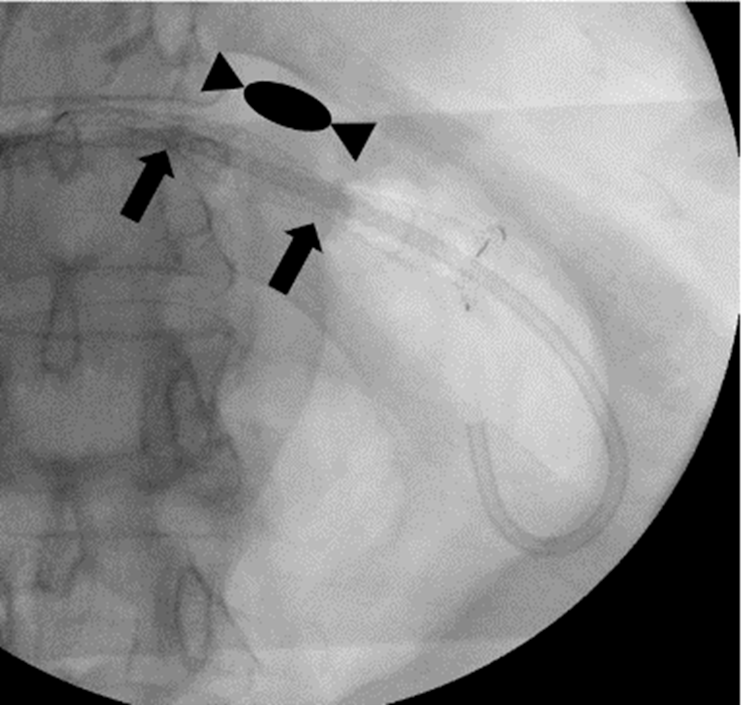
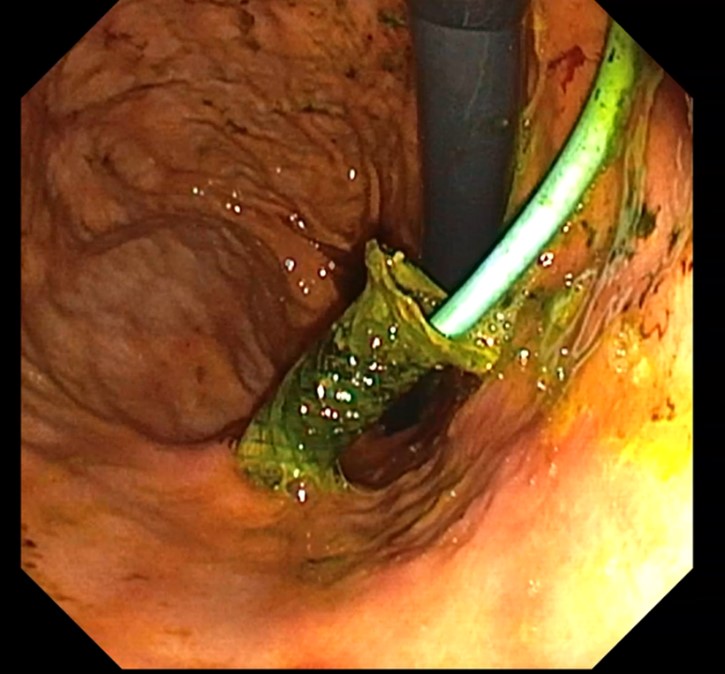
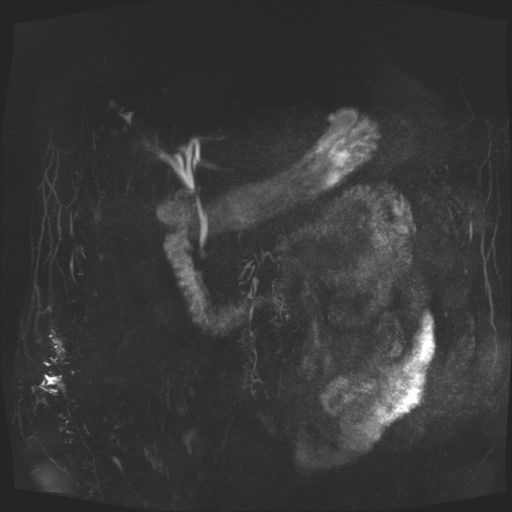
Cu pacientul în decubit dorsal, intubat orotraheal si ventilat mecanic, folosind un ecoendoscop linear, s-a identificat prin abord transgastric un ram biliar dilatat situat in segmentul III hepatic, care a fost puncționat cu ac FNA de 19 G, efectuând inițial o colangiogramă (Fig. 2 a, b). Ulterior, s-a avansat fir ghid de 0,035 inch dincolo de stenoză până la nivel duodenal (Fig. 2c), după care s-a creat traiectul fistulos cu un cistotom de 6F (Fig. 2d). În final, s-a plasat un stent metalic 10/100 mm de tip GIOBOR, cu capătul proximal neacoperit în căile biliare și cel distal, prevăzut cu o flanșă, în stomac. Controlul fluoroscopic a arătat că stentul are două îngustări separate printr-o umflătură intermediară („candy sign”; Fig. 3). Un stent dublu pigtail de 10-Fr x 100 mm a fost plasat în proteza metalică pentru a preveni dislocarea și migrarea ei (Fig. 4 a,b).
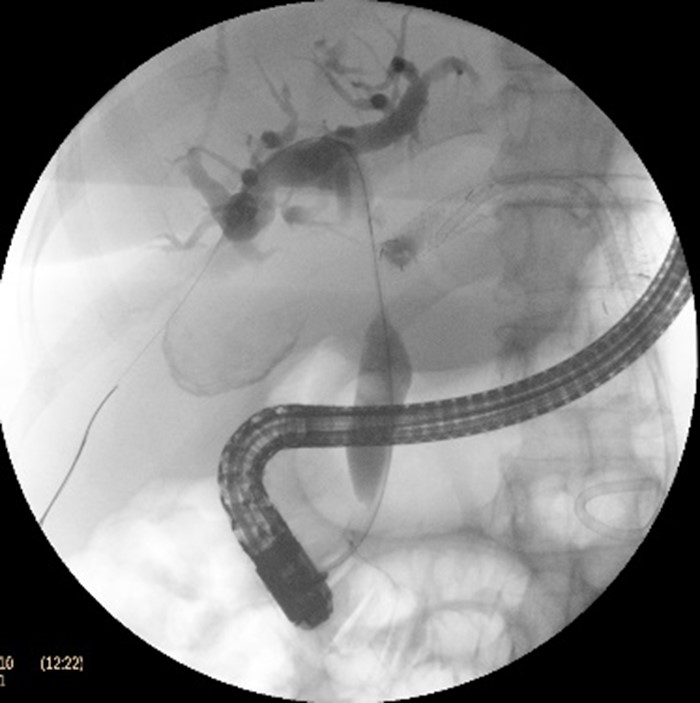
Ulterior s-a practicat și ERCP cu protezarea CBIH drepte, prin montarea unui stent biliar de plastic de 8,5 Fr x 120 mm (Fig.5).
CT de control la 24 ore a confirmat prezența ambelor stenturi transgastrice cu pozitionare corectă, fără complicații locale (Fig. 6).
Evoluția nu a fost grefată de evenimente adverse precoce sau tardive, cu ameliorare clinico-biologică, reflectată în reducerea colestazei și remiterea progresivă a icterului sclero-tegumentar, fiind externată și propusă pentru chimioterapie.
Icter obstructiv prin tumoră Klatskin Bismuth-Corlette IV. Drenaj biliar prin EUS HGS și ERCP.
Stenozele maligne hilare reprezintă o provocare pentru orice endoscopist, fiind stenoze înalte, complexe, care necesită plasarea de stenturi multiple și care au un risc mare de complicații (angiocolită, pancreatită, ocluzia stentului). Multă vreme drenajul percutanat (PTBD) a fost considerat prima opțiune în aceste situații.
Deși PTBD prezintă o rată de succes ridicată, cel mai mare dezavantaj este calitatea vieții pacientului, dar și discomfortul, durerea și complicațiile (peritonita biliară, deplasarea tubului de dren, angiocolita) asociate tubului de dren extern. Drenajul endoscopic prin ERCP are mare marele avantaj al absenței complicațiilor de mai sus, precum și posiblitatea de a restabili anatomia bilio-digestivă. Cu toate acestea, sunt situații care necesită prezența unui expert endoscopist. Introducerea bilaterală a stenturilor fie de plastic, fie metalice, este tehnic dificilă și necesită inserarea unui fir ghid in ambele căi intrahepatice și apoi inserarea secvențială a stenturilor. Inserarea celui de-al doilea stent sau chiar al treilea după deploierea primului este dificilă într-un canal biliar stenozat tumoral. Acest dezavantaj poate fi depășit atunci când se utilizează proteze cu diametru mai mica, dar cu permeabilitate mai mică.
Drenajul biliar ghidat ecoendoscopic (BD), în cazul nostru EUS-HGS, este o opțiune pentru tratarea icterului obstructiv, fiind o alternativă la intervenția chirurgicală și PTBD. Efectuarea EUS-HGS are avantajul că evită complicațiile ERCP, de tipul: pancreatită, tumor ingrowth și colmatarea stentului, știindu-se, în plus, că EUS-HGS are rată mai mică de reintervenție față de protezarea prin ERCP. Cu toate acestea, există și limitări ale procedurii, determinate de prezența ascitei în cantitate mare, a metestazelor hepatice în lobul stâng și, bineînțeles, de capacitatea și gradul de pregătire ale endoscopistului, care nu sunt disponibili în toate centrele.
Cazul de față ilustrează impactul semnificativ al EUS-HGS asupra evoluției din toate punctele de vedere a pacienților cu obstrucție biliară malignă datorată obstrucției hilului hepatic, fiind o strategie alternativă valabilă pentru drenajul biliar extern, permițând totodată începerea timpurie a chimioterapiei, după rezolvarea icterului.
- Schoch, Armelle1; Lisotti, Andrea1,2; Walter, Thomas3; Fumex, Fabien1; Leblanc, Sarah1; Artru, Pascal1; Desramé, Jérôme1; Brighi, Nicole4; Marsot, Julien5; Souquet, Jean-Christophe6; Napoléon, Bertrand1,. Efficacy of EUS-guided hepaticogastrostomy in prolonging survival of patients with perihilar cholangiocarcinoma. Endoscopic Ultrasound 11(6):p 487-494, Nov–Dec 2022. | DOI: 10.4103/EUS-D-22-00014
- Giovannini, Marc1,. EUS-guided hepaticogastrostomy. Endoscopic Ultrasound 8(Suppl 1):p S35-S39, November 2019. | DOI: 10.4103/eus.eus_47_19
- van der Merwe SW, van Wanrooij RLJ, Bronswijk M, Everett S, Lakhtakia S, Rimbas M, Hucl T, Kunda R, Badaoui A, Law R, Arcidiacono PG, Larghi A, Giovannini M, Khashab MA, Binmoeller KF, Barthet M, Perez-Miranda M, van Hooft JE. Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2022 Feb;54(2):185-205. | DOI: 10.1055/a-1717-1391.
- Feldman, E. J., Friedman, L. S., & Brandt, L. J. (2015). Sleisenger and Fordtran’s gastrointestinal and liver disease (Issue 1, p. 1). http://lib.tums.ac.ir/site/catalogue/8070
- Paik WH, Park DH. Outcomes and limitations: EUS-guided hepaticogastrostomy. Endosc Ultrasound. 2019 Nov 28;8(Suppl 1):S44-S49. | DOI: 10.4103/eus.eus_51_19.